Как происходит изменение свойств химических элементов
Изучение изменений свойств химических элементов важно для понимания их поведения в химических реакциях и реакционной способности. Таблица химических элементов Менделеева является основой для классификации элементов и предоставляет систематическую организацию, основанную на их атомных свойствах. Позиция элементов в периодической таблице позволяет предсказывать их химические и физические свойства, их реакционную способность и взаимодействие с другими элементами.
Закономерности изменений свойств химических элементов в группах и периодах таблицы Менделеева можно описать следующим образом:
Слева направо по периоду:
- Металлические свойства простых веществ обычно уменьшаются. Это связано с увеличением электроотрицательности элементов и уменьшением радиуса атомов.
- Неметаллические свойства, наоборот, увеличиваются. Это происходит из-за увеличения электроотрицательности и уменьшения радиуса атомов.
- Радиус атома уменьшается по мере движения слева направо по периоду. Это связано с увеличением числа протонов в ядре, что увеличивает притяжение к электронам и сокращает размер атома.
- Электроотрицательность элементов возрастает. Электроотрицательность — это способность атома привлекать к себе электроны в химической связи. По мере движения слева направо по периоду, атомы становятся более электроотрицательными.
- Восстановительные свойства элементов обычно уменьшаются. Это связано с увеличением электроотрицательности и уменьшением радиуса атомов.
- Окислительные свойства элементов, напротив, обычно увеличиваются. Это связано с увеличением электроотрицательности и уменьшением радиуса атомов.
Если рассматривать движение вниз по группе (вертикально по таблице Менделеева), то для главной подгруппы закономерности изменений свойств химических элементов будут следующими:
- Металлические свойства простых веществ обычно увеличиваются. Это связано с увеличением размера атомов и уменьшением силы притяжения между атомами.
- Неметаллические свойства, напротив, обычно уменьшаются. Это связано с увеличением размера атомов и уменьшением электроотрицательности.
- Радиус атома обычно увеличивается по мере движения вниз по группе. Это происходит из-за увеличения количества энергетических уровней и уменьшения притяжения ядра к валентным электронам.
- Электроотрицательность элементов, наоборот, уменьшается по мере движения вниз по группе. Это связано с увеличением размера атомов и увеличением расстояния между ядром и внешними электронами.
- Основные свойства оксидов и гидроксидов обычно усиливаются по мере движения вниз по группе. Это связано с увеличением количества энергетических уровней и увеличением размера атомов.
- Кислотные свойства оксидов и гидроксидов, наоборот, обычно убывают по мере движения вниз по группе. Это связано с увеличением щелочности водных растворов.
Число электронов на внешнем уровне обычно не меняется при движении вниз по группе, так как элементы в одной группе обычно имеют одинаковое количество валентных электронов.
Основные, кислотные и амфотерные оксиды определяются на основе ионной характеристики вещества.
- Основные оксиды обычно являются соединениями металлов с положительными степенями окисления, такими как +1 и +2. Они обычно обладают щелочными свойствами в растворах воды и реагируют с кислотами, образуя соли и воду.
- Кислотные оксиды обычно образуются неметаллами и металлами с высокими степенями окисления, такими как +5, +6 и +7. Они обычно обладают кислотными свойствами в растворах воды и реагируют с основаниями, образуя соли и воду.
- Амфотерные оксиды способны реагировать как с кислотами, так и с основаниями. Некоторые металлические оксиды, такие как Al2O3, BeO, ZnO и Cr2O3, могут проявлять амфотерные свойства. Они могут вести себя как основания в кислых условиях и как кислоты в щелочных условиях.
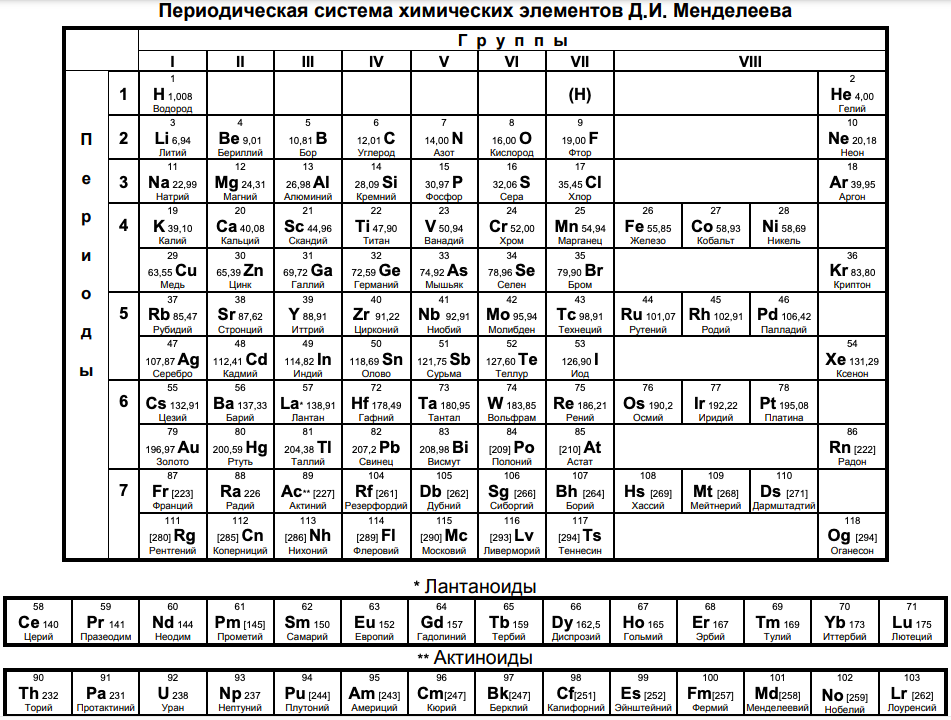
Изменения свойств химических элементов в группах и периодах периодической таблицы Менделеева имеют свои закономерности и особенности. Понимание этих изменений позволяет предсказывать химическое поведение элементов, а также применять их в различных областях науки и технологии, включая синтез химических соединений, разработку новых материалов и технологий, а также в медицине, сельском хозяйстве и промышленности. Таким образом, знание закономерностей изменений свойств химических элементов является ключевым элементом в изучении химии и ее применении в различных областях жизни.

